Forschung Ulrich Weininger
Meine Forschung beschäftigt sich mit der Struktur und Dynamik von Proteinen im allgemeinen und der Dynamik von Seitenketten im speziellen, mit einem Schwerpunkt auf aromatischen Seitenketten.
NMR Struktur von Proteinen
Die Strukturen folgender Proteine wurden von mir oder mit meiner Hilfe mittels NMR Spektroskopie bestimmt:
Methoden zur Untersuchung der Dynamik von Seitenketten
Zur Untersuchung der Dynamik von Aminosäure Seitenketten wurden folgende Methoden entwickelt:
|
|
Isotopenmarkierung |
Ortselektive 13C Markierung von Proteinen mit Erythrose
Ortselektive 13C Markierung von Proteinen mit Ribose
Isotopenmarkierung von aromatischen Seitenketten
|
|
NMR Dynamik von Methylgruppen |
1H und 13C CPMG Relaxationsdispersion von Methionin
1H R1rho Relaxationsdispersion von Methylgruppen

|
|
NMR Dynamik von aromatischen Seitenketten |
13C Relaxationsexperimente in aromatischen Seitenketten
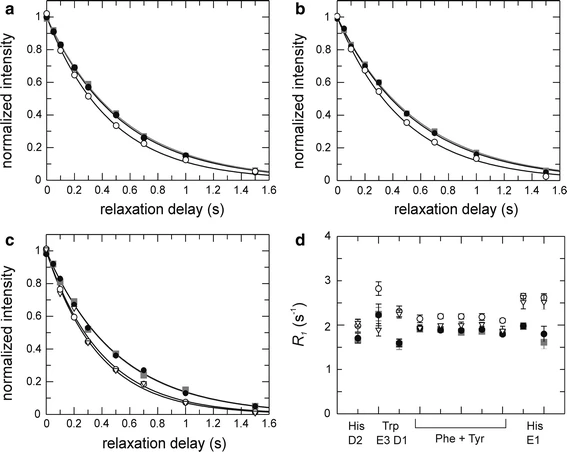
13C CPMG Relaxationsdispersion in aromatischen Seitenketten
1H CPMG Relaxationsdispersion in aromatischen Seitenketten
1H CPMG Relaxationsdispersion in aromatischen Seitenketten 2

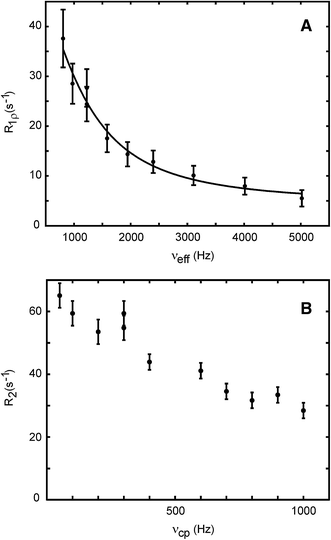
13C R1rho Relaxationsdispersion in aromatischen Seitenketten
1H R1rho Relaxationsdispersion in aromatischen Seitenketten
RDC basierte Relaxationsdispersion von aromatischen Seitenketten

Seitenketten Dynamik in Proteinen
Untersuchungen zur generellen Funktion von Proteinen durch Seitenkettendynamik
Dynamik aromatischer Seitenketten im aktiven Zentrum von FKBP12

Dynamische allosterische Kommunikation im Glucocorticoidrezeptor

Energetik und Dynamik des Protonenshuttles von CA II
ring flips
Experimente zur Dynamik aromatischer Seitenketten ermöglichen die Identifikation und Quantifizierung von ring flips, welche transiente Umlagerungen in Proteinen sichtbar machen
NMR Untersuchungen von ring flips

ring flips in BPTI nachgemessen

ring flips im aromatischen Cluster von GB1
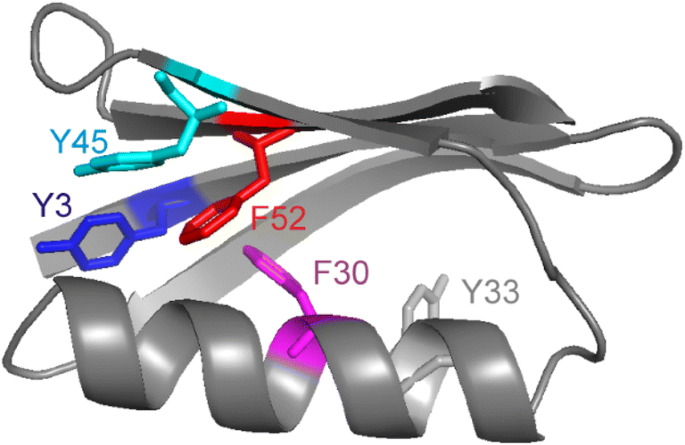
ring flips ohne Unterschiede in der chemischen Verschiebung

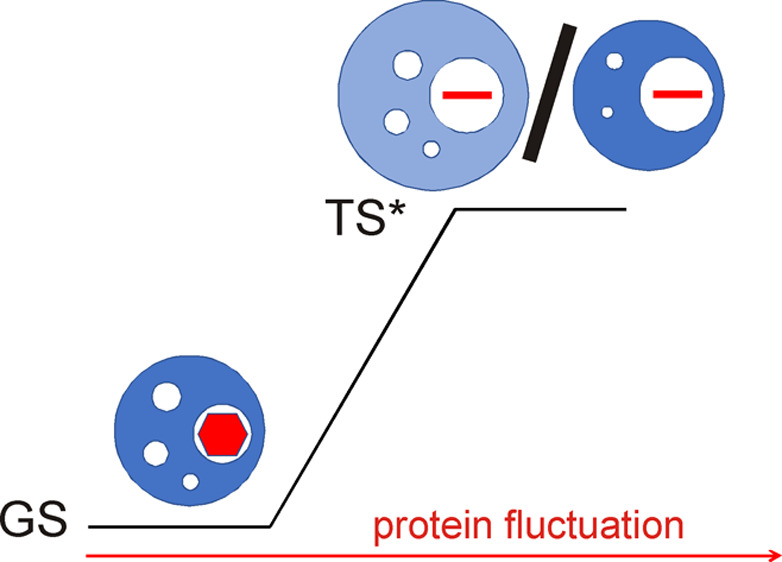
Kompressibilität im Übergangszustand von ring flips
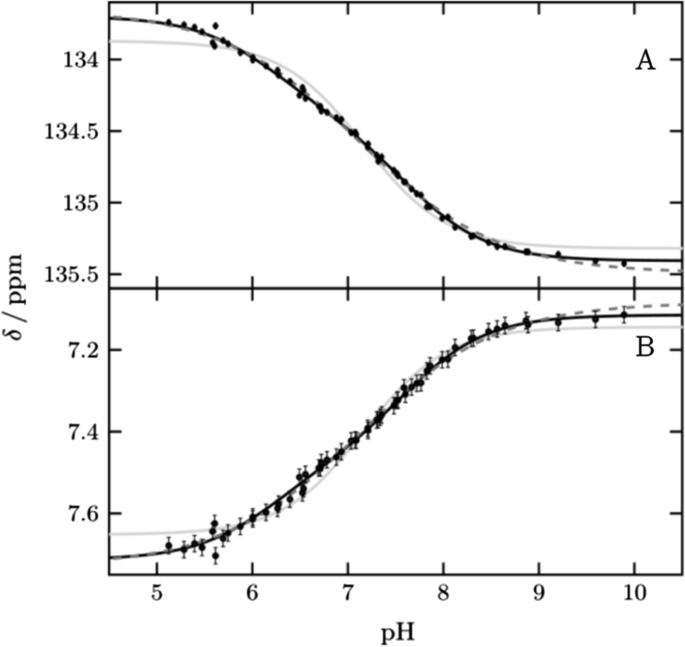
Protonierungskinetiken von Seitenketten
NMR Relaxation ermöglicht es die Protonierungskinetiken (on & off) in Seitenketten von Proteinen pH und pKa abhängig zu messen
ortsspezifische Protonierungskinetiken in sauren Seitenketten

Protonierungskinetiken in Histidinen

Protonierungszustände von Histidinen
Histidine kann in Kombinationen von 3 Zuständen vorliegen, welche mit NMR untersucht werden können
Die Karbohydrat Bindestelle in Gal3 ist vororganisiert
Protonenbesetzungsgrade in Histidin Seitenketten

pKa Wert Bestimmung
Experimentelle pKa Wert Bestimmung eines hyperstabilen Proteins
Energetik und Dynamik des Protonenshuttles von CA II
Protonenbesetzungsgrade in Histidin Seitenketten

Aggregation
Coaggregation von Ab40 und Ab42
DNAJB6 inhibiert die Aggregation von Ab42
alpha synuclein Aggregation
Sekundärnukleation

Proteinfaltung mit NMR
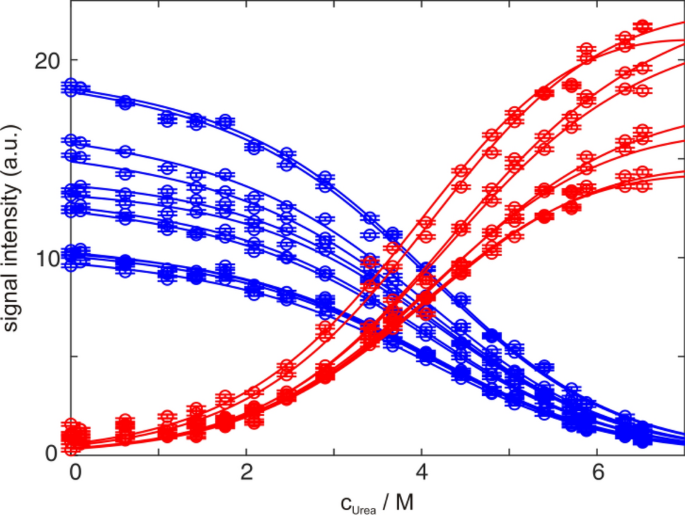
Stabilisierung des Nativen Zustandes von GB1 durch Druck
Proteinfaltung mit NMR
PPIasen
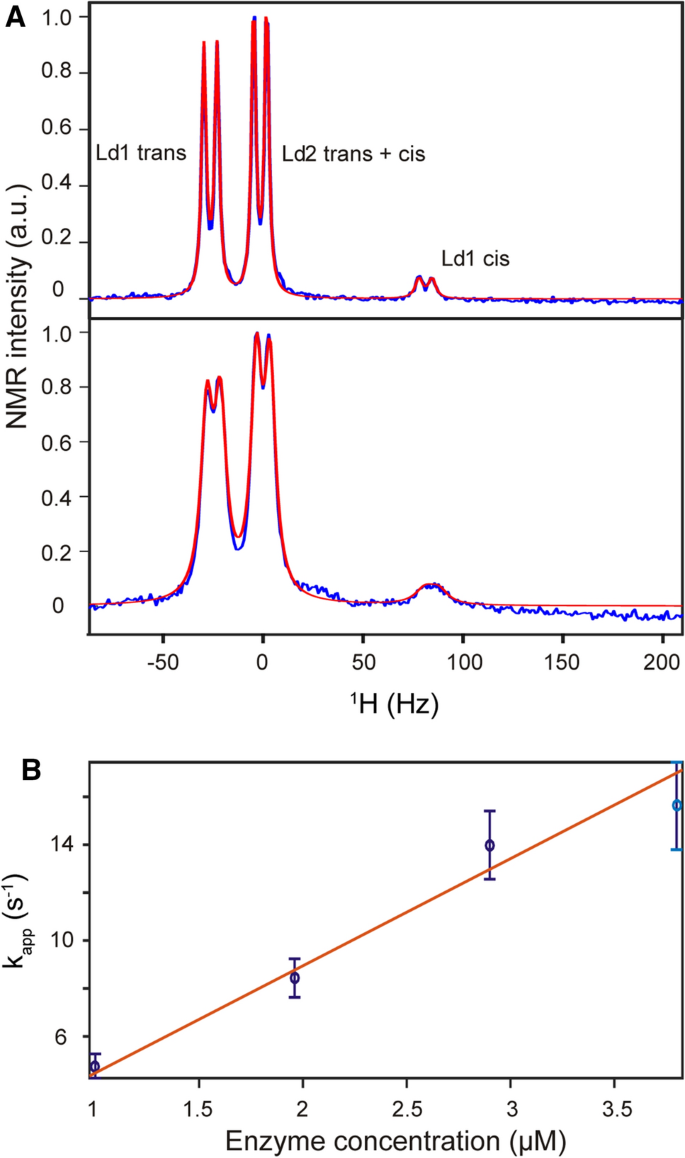
Substraterkennung und katalytischer Mechanismus von SlyD
Einfluß entfernter Reste des Substrats auf die enzymatische Aktivität von SlyD